type
status
date
slug
summary
tags
category
icon
password
2.1 单电子原子的薛定谔方程及其解
我们在求解单电子原子如H原子、和等粒子时,得到薛定谔方程为
[什么是折合质量?]

当我们研究两个相互作用的质点组成的系统的运动时(如A和B),两个物体都在动,研究起来比较麻烦。为了简化,尝试将一个物体(A)视为静止,只观察另一物体(B)的运动。在新的参考系下,B的质量为折合质量
证明如下:
对于物体A
对于物体B
当把A看做静止时,B相对A的加速度为
由牛顿第三定律得
通过这个转化我们就将二体问题转化为以A为参考系,物体B运动的单体问题。新的体系下物体B的加速度为,质量为
当我们研究氢原子中电子的波函数时,本质是在研究原子核和电子之间的一个二体运动,为了简化运算,将电子的质量换算为了折合质量。
观察薛定谔方程,发现势能项里存在变量半径,为了方便计算,采用Laplace算符的球坐标形式
带入薛定谔方程整理得
令,带入薛定谔方程整理得到三个常微分方程:R方程,方程和方程,用解常微分方程的方法,求得3个方程满足的品优条件的解,乘在一起得
其中方程比较好解,为常系数二阶齐次线性方程
根据归一化条件以及得到复数形式的解为
复数形式的对角动量沿z轴分量的算符,是本征函数,但复数不容易画图。
根据态叠加原理,将两个特解进行线性组合仍是的解,将其线性组合可得到实函数解
但实函数解对角动量沿z轴分量的算符不是本征函数,但便于作图。
注:复函数解和实函数解不是一一对应关系,而是线性组合关系。
对于得到的称为原子轨道函数,简称原子轨道,其中n(主量子数),l(角量子数),m(磁量子数)
其中称为波函数的径向部分,称为波函数的角度部分,是个球谐函数。

2.2 量子数的物理意义
主量子数n
在解方程时,得到
即n决定了体系能量的高低,相邻两能级差随n增大逐渐减小
零点能效应:受一定势场束缚的的微观粒子在能量最低的基态时仍然在运动。
问题:氢原子基态时总能量,动能是多少? 势能又是多少? 动能和势能的占比是怎么分配的呢?
位力定理:对势能服从规律的体系,平均势能和平均动能满足:
原子核和电子之间为库伦作用,势能为规律
所以
联立
得
角量子数l
单电子原子的轨道波函数对角动量平方算符是本征函数
所以
即决定了电子轨道角动量,被称为(轨道)角量子数

带电粒子有了角动量就会有磁矩,磁矩与角动量的关系为
磁量子数m
单电子原子的轨道波函数对角动量在z方向的分量算符是本征函数
所以
同理,单电子原子的轨道波函数对磁矩在z方向的分量算符是本征函数
所以
即m不仅决定了轨道角动量在z方向分量的大小,还决定了轨道磁矩在z方向分量的大小,所以m被称为(轨道)磁量子数。
自旋量子数s和自旋磁量子数
类似于l和m这一对,s和是一对。
Stern-Gerlach(斯特恩-盖拉赫)实验证明,除了轨道运动电子还有自旋运动
自旋角动量在z方向的分量和自旋磁矩在z方向的分量满足
总(角)量子数和总磁量子数
电子既有轨道角动量,又有自旋角动量,把这两个加在一起称为总角动量
**注:**j的取值不能写成,因为为整数,为半整数, 取不到0
电子的总角动量在z轴的分量
总结

2.3 波函数和电子云图形
2.3.1 图和图
这两种图一般只用来表示s态分布,因为只有s态的波函数只与r有关。
图:从左至右分别为1s,2s,3s,零点数等于n-1。

图:节点数等于n-1。

2.3.2 径向分布图
对进行空间积分
令

Ddr的物理意义是在半径r和r+dr的两个球面夹层中找到电子的概率


对于主量子数为n,角量子数为l的状态,极大值峰有个,节面(原点除外)个。
2.3.3 原子轨道等值线图
球节面数:,角节面数:

图中角节面数为1,球节面数为1,所以显示的为3p轨道
以等值线图为基础,派生出几种其他图形。
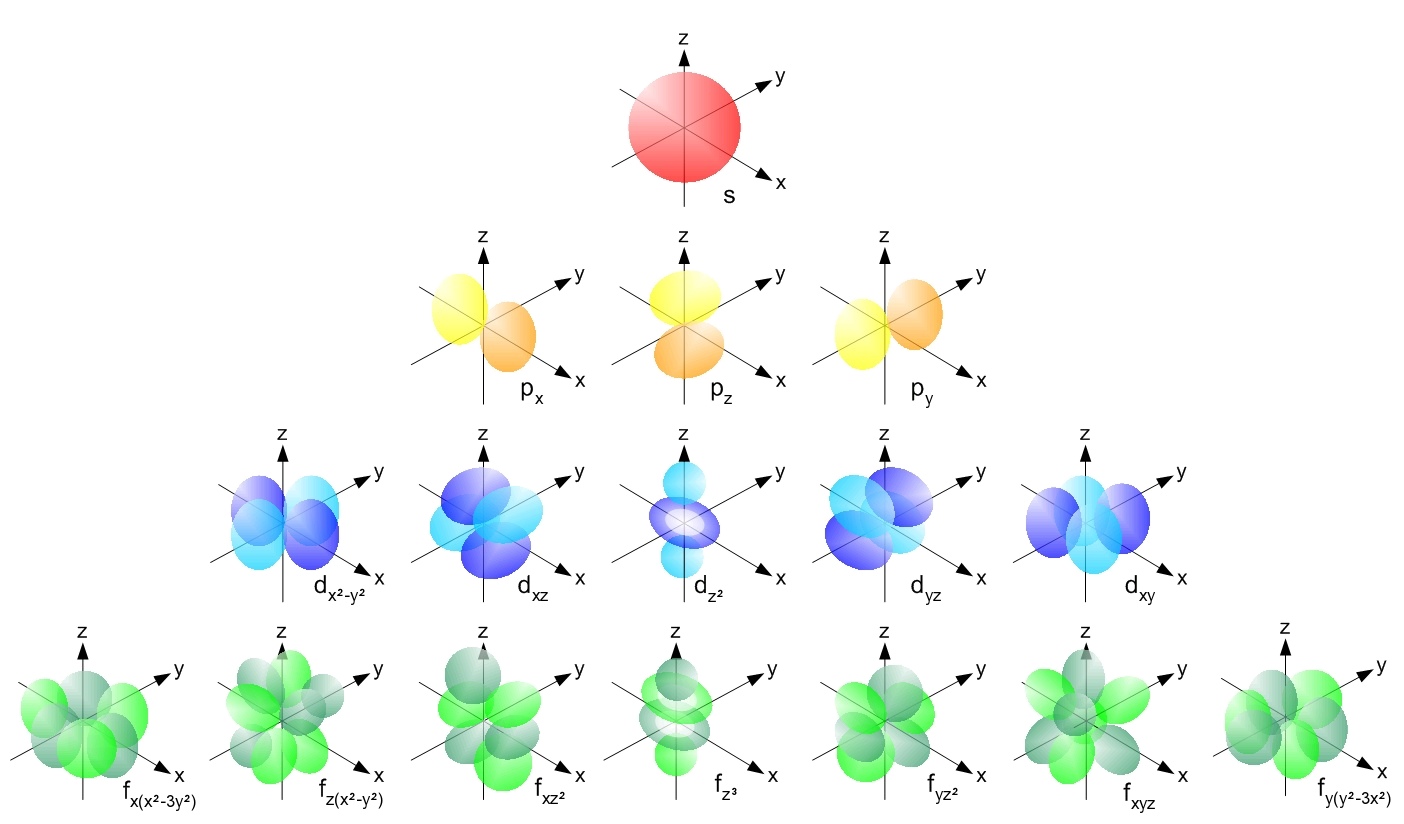

总结
本节主要内容为看懂电子云图像,能够根据电子云图像判断属于什么轨道。
径向分布图:极大值峰有个,节面(原点除外)个。
原子轨道等值线图:球节面数,角节面数
2.4 多电子原子的结构
2.4.1多电子原子的薛定谔方程及其近似解

以最简单的多电子原子氦原子为例,薛定谔方程为
[原子单位]
为了方便书写,让下表中符号一栏=1au,即等等

氦原子的薛定谔方程用原子单位(Atomic unit)表示为
同理,原子序数为Z,含n个电子的原子的薛定谔方程为
因为由i电子和j电子的坐标决定,不可能让化简成只和i或者j电子相关的一个变量,即无法分离变量,不能用解单电子原子的方法解多电子原子的薛定谔方程,只能采取近似的方法。
“暴力”近似
直接忽略掉这一项
令,分离出n个方程
再按照变数分离法,求解和
这种方法误差很大,一般不用。
中心场近似
将原子中其他电子对第i个电子的排斥作用看成球形对称的并且只与径向相关的力场。

第i个电子的势能满足
薛定谔方程为
解得
最后
[Slater规则]
(1)电子排序分组,排序按照从主量子数增大、角量子数增大;分组按照sp一组,其余单独成组
(2)外层电子对内层电子无屏蔽作用,
(3)同组电子,
(4)相邻内一组
(5)更向内组
适用于主量子数1~4轨道,其余准确性较差
自洽场法
假定第i个电子处在原子核与其他(n-1)个电子形成的平均势场中,即把原子核与其他(n-1)个电子看成一个等效电荷(类似于中心场近似),此时i电子的势能为。与中心场近似不同的是,求解这个“等效电荷”的方法为
求时,需要假设(假设的方法可以很随意,比如利用“暴力”近似解出的波函数);求时,需要假设;求出一轮的波函数。进行下一次循环,逐渐逼近。

2.4.2 单电子原子轨道能和电子结合能
单电子原子轨道能:单电子波函数对应的能量值。
电子结合能:即第一电离能,中性原子中当其他电子均处在可能的最低能态时,某电子从指定轨道上电离所需能量的负值。可以反映电子能级的高低。
1.屏蔽效应和钻穿效应
专业定义
屏蔽效应:多电子原子中核电荷对某一电子的吸引作用,部分地被其他电子对该电子的排斥作用相抵消的效应。
钻穿效应:多电子原子中每个电子为避开其他电子的屏蔽,其电子云钻到进核区而感受到更大核电荷作用的效应。
通俗理解
屏蔽效应和钻穿效应强调的重点不同。
屏蔽效应强调客观事实,也就是说一个电子因为其他电子的客观存在,它状态发生了改变。
钻穿效应强调主观能动性,也就是说一个电子通过一定手段阻止这种改变的发生。
举例:
在一个学习氛围浓厚、老师讲课十分有趣的课堂中,班内所有的学生都非常向往能够坐在前排,这样就可以近距离与老师交流互动。由于课堂内有多名学生,座位靠后的学生因为前排同学的存在,导致了自己不能与老师近距离互动,这就是“屏蔽效应”。后面的学生也想近距离听到老师讲课呀,于是他们就搬着自己的板凳做到了前排的位置,但由于自己的桌子还在后排,过一会自己还得回到自己的座位上,这样学生通过“把凳子搬到前排”这个行为,实现了自己可以在一段时间内和老师交流互动。这种学生通过某种手段,改变了自己只能在后排与老师交流互动的状态称为“钻穿效应”。最后学生可以和老师交流互动的机会,可以由学生桌子的位置(学生大部分时间所处的位置)和学生凳子搬到的位置(学生小部分时间所处的位置)所决定。
在一个原子中,老师就是带正电的原子核,学生就是带负电的电子,学生想要坐到前排的动力就是库仑力,教室内的桌子就是能级的主峰,凳子就是能级的小峰,把凳子搬到前排这个行为就是电子在靠近核电荷处有个小峰。


根据图像,n越大,主峰能级离核越远,能级的能量越高,即

根据图像,由于钻穿效应的存在,s态的峰的数目最多(峰的数目等于),虽然主峰距离核更远,但小峰离核更近,最终导致能级的能量更低,即

综上,“n 小 小” 能量低,“n 大 大” 能量高

而“n 小 大”或者“n 大 小”仅能通过Slater规则粗略估计,而且各种能级高低不是固定不变的,而是随着核电荷数发生改变。当n足够大时,能量主要由n决定。如:
2.用Slater规则求单电子原子轨道能
[Slater规则]
(1)电子排序分组,排序按照从主量子数增大、角量子数增大;分组按照sp一组,其余单独成组
(2)外层电子对内层电子无屏蔽作用,
(3)同组电子,
(4)对于s,p电子,相邻内一组);对于d,f电子,相邻内一组
(5)更向内组
适用于主量子数1~4轨道,其余准确性较差
以碳原子为例,2s或者2p能级的单电子原子轨道能为

通过对比
可得一组电子的单电子原子轨道能之和等于对应电离能和的负值,即
所以对于单电子原子或最外层只有一个电子的原子(如:),第一电离能等于单电子原子轨道能;其他情况(如He),则单电子原子轨道能等于该组电子电离能的平均值。
例题:计算He原子的1s轨道能、原子总能量,

2.4.3 基态原子的电子排布
遵循原则:能量最低原则、泡利原理、洪特规则

[记忆方法]
1.值小的在前
2.值相等,则小的在前
Slater行列式
为了让波函数描述电子的自旋状态,引入自旋波函数,它有两个值代表自旋向上,代表自旋向下。
以He原子为例,我们可以用代表1s轨道上自旋向上的电子,并称其为1号电子;
同理,我们可以用代表1s轨道上自旋向下的电子,并称其为2号电子。
现在想构造一个全波函数来描述He原子的电子状态,对这个全波函数的要求是满足泡利原理,即,通过线性组合以及归一化,我们可以得到全波函数
这个行列式称为Slater行列式。
含n个电子的Slater行列式为
总结
1.

2.一组电子的单电子原子轨道能之和等于对应电离能和的负值
3.电子排布规律
2.5 光谱项
首先需要分清字母符号之间的对应关系

电子排列满足的原则:能量最低原则、泡利不相容原理和洪特规则
多电子光谱支项
(1)确定L
(2)确定S
(3)确定J
(3)确定光谱支项
基态光谱支项求法
(1)画出未充满能级的轨道分布图。优先箭头朝上,电子从左到右

(2)标注m、m_s的值 m值从左到右依次减小,箭头朝上为,箭头朝下为
(3)确定L L等于电子数乘以对应m值,如
(4)确定S S等于电子数乘以对应值,如
(5)确定J 若电子数未半充满,则,否则J=L+S,如
(6)确定光谱支项
L值 | 0 | 1 | 2 | 3 |
对应符号 | S | P | D | F |
如:
- 作者:XUPIPI
- 链接:https://tangly1024.com/article/cbe1a90a-d7eb-4a0a-9018-1a85fdee8830
- 声明:本文采用 CC BY-NC-SA 4.0 许可协议,转载请注明出处。